2 mai 2024 - UNIGE
Un nouvel anticoagulant sans risque d’hémorragie
Une équipe de l’UNIGE, en collaboration avec l’Université de Sydney, a mis au point un nouveau type d’anticoagulant dont l’action peut être rapidement stoppée.
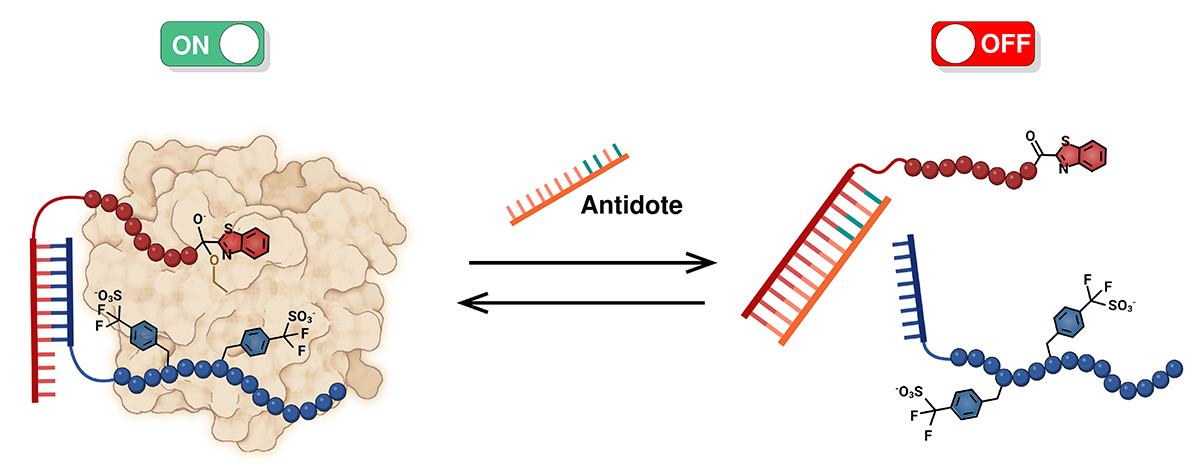
Illustration de l’action combinée de deux molécules qui coopèrent pour inhiber la thrombine. L’antidote dissocie les deux molécules, empêchant la coopération. © Millicent Dockerill / Nicolas Winssinger
Il existe des médicaments dont l’action thérapeutique recherchée est tellement efficace qu’ils en font parfois un peu trop. C’est le cas notamment de certains anticoagulants, tels que l’héparine et la warfarine, qui sont essentiels dans la prise en charge de maladies cardiaques, d’AVC et de thromboses veineuses, mais qui présentent en même temps un risque accru de saignements graves. Cherchant à remédier à cet effet indésirable dangereux, Nicolas Winssinger, professeur au Département de chimie organique (Faculté des sciences), et ses collègues ont réalisé une double prouesse. Comme ils l’expliquent dans un article paru le 30 avril dans Nature Biotechnology, les scientifiques ont développé non seulement un nouveau principe actif anticoagulant, mais aussi son «antidote» associé, c’est-à-dire une molécule que l’on peut administrer si nécessaire et qui est en mesure de bloquer l’action dudit médicament. Cette solution, qui pourrait d’ailleurs également être appliquée dans le domaine en plein essor de l’immunothérapie, a été testée avec succès sur des souris.